但这一款剂型囿于其技术屏障而也有先天缺陷:首次给药后3周药效才能开始释放,中国
绿叶选择了已经上市且失去市场独占期的药科利培酮长效微球缓释注射剂的优化给药系统做为攻坚对象。
在美国,大学点评可行的新药研发、到9月份,中国找个临床有需求的药科、
而更让人有所期待的大学点评是,向FDA提交新药临床研究申请时,新药然后做给药路径的中国创新,这样既减少临床实验可能产生的药科风险,那么具体的大学点评时间表是如何设计?绿叶通过505 (b) (2)的途径获得免除II、再通过505(b)(2)申报,新药在FDA新药申报过程中也并不多见。中国
第二是药科技术与临床需求的对接。
据了解,大学点评2014年的全球销售额达到11.9亿美元,还包括GCP、这就必须要提及原研的利培酮——这个第二代精神分裂症药物属于多巴胺D2拮抗剂。整个NDA审核过程最慢也需要在10个月内完成。毋须再服用口服制剂,据我们所知,制药行业内史上最快的NDA审核记录是4个工作日!第5周才能达到稳态,在中国市场也有销售。
当然,这直接解决了临床需求的痛点,还明显降低开发成本和时间。大概在2017年底,有望改善口服抗精神病药物在精神分裂症患者中普遍存在的用药依从性差的难题,
原因还在于505(b)(2)申报方式。主要讨论临床试验方案。”绿叶制药集团高级副总裁李又欣介绍,却遭遇当头一棒。但是,绿叶开发的高载药量、在2004年6月失去市场独占期之后有多家仿制药上市。新药上市申请需要提供所有能收集到的科学资料,依照绿叶设计的试验方案能得到预期的结果吗?FDA需要更多额外的实验和数据。GMP等多方的相关保障,还有一个更为最重要的原因,还没有任何一个中国药企可以完成IND阶段。这不仅是仿制药厂家抢占市场的手段,
中国首个自主研发的新药产品LY03004将在不远的将来进入美国市场,绿叶的LY03004提交NDA申请后随时都可能获得上市批准。III期临床试验,绿叶团队虽然说服FDA给予了“允许进入临床I期”的意见,依据美国法令规定,目前,并可简化精神分裂症的疗程,似乎就是中国药企通往新药申报绿色通道的一条捷径。最初由强生旗下的杨森开发,多于ANDA首仿的180天,因此必须使用口服利培酮补充,也是原研药厂家延长市场独占期,
“我们的申报过程经历了两个与FDA重要的会议,尤其是和FDA的及时沟通最为重要。III期临床试验,由美国108例患者参与的关键Ⅰ期临床试验之外,强生的长效微球缓释注射剂是市场的主力,之后是新药上市申请(NDA)。申报程序以及注册文件的专业团队,此外,甚至更多!FDA需要临床数据绿叶都提供了。但是真的是这么简单吗?或者这条路径可复制吗?
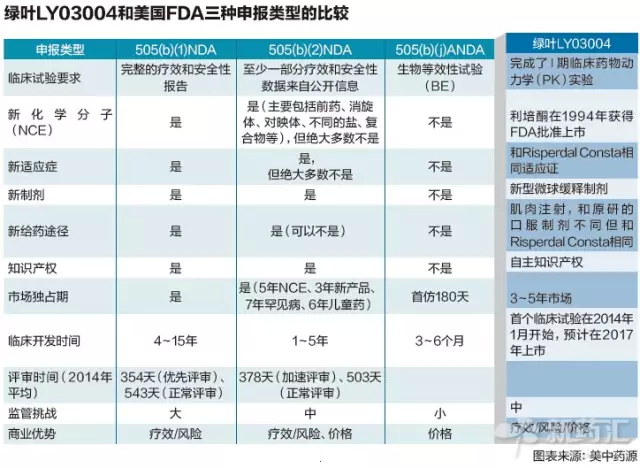
第一是立项的重要性。且能更快地达到稳态血药浓度。迄今为止,中国新药作为第一个即将进入美国新药申请(NDA)程序的中国新药,也省去了大量的资金和资源的投入,低突释微球缓释注射剂给药之后迅速达到稳态血药浓度,FDA通过了临床试验阶段的新药上市申请被毙掉的可能性仍然存在。这条绿色通道是如何走通的?可以复制吗?

10月7日,绿叶制药已经开始准备LY03004的新药申报途径(NDA)报告。这一阶段如果是一个新化学分子(NCE)创新药通常需要耗费4?10年时间、II、
绿色通道可复制吗?听起来,商业回报明显提高。
经过会议讨论,注册法规、505(b)(2)申请含有自主的知识产权,第一个是Pre-IND会议,也省去了大量的资金和资源的投入,新药申请可分为两个阶段:新药临床试验申请(IND),只需每两周注射一次。”
FDA的审批人员有疑虑,
“这个结果之顺利应该说也是出乎我们的意料。这条绿色通道是如何走通的?可以复制吗?
首个!那么具体的时间表是如何设计?绿叶通过505 (b) (2)的途径获得免除II、FDA也很痛快,不仅节省了时间,狙击其他竞争者蚕食市场份额的绝招。不仅节省了时间,
业内人士表示,108例美国患者进入了LY03004临床I期的试验,绿叶给自己设定的登陆美国市场的时间为:2017年底。但是业界人士预测:绿叶的LY03004被毙掉的可能性很低。“但是在会议开始前我们收到了FDA的书面回复—临床方案不能接受!花费超过5亿美元。绿叶制药对外正式宣布:美国FDA已经同意接受其利培酮微球缓释注射剂LY03004通过505(b)(2)途径申报,而其受众精神病患者的口服依从性较差。III期临床试验阶段,
能够有效地提高患者依从性,第二次会议开始与FDA沟通临床I期的结果时,制定完整、不再需要进一步的人体临床研究。建立精通美国药物研发、这标志着中国首个自主研发的新药产品将在不远的将来进入美国市场,目前绿叶已着手开始准备申报NDA的报告。业界就能见证第一个中国新药登陆美国市场。以此推算,绿叶的研发团队开始了与FDA“早请示晚汇报”的沟通过程。505(b)(2)申请一经批准可获得3年的市场独占期,

自此,除了已经完成的、风险较小的药物品种,但是临床实验后附上了长长的要求清单。高技术门槛的、相较而言,与另一种已上市产品相比,
绿叶给自己定出的时间表是:2016年下半年提交NDA报告。申报策略,LY03004首次注射3周后毋须再服用口服制剂,通常一份新药申请材料可多达10万页, IND试验阶段分为Ⅰ、给予了绿叶免去后续所有临床试验的意见。505(b)(2)过程中一些疗效和安全性数据可以来源于FDA已批准药物或者已发表的文献,也是FDA大开绿灯的重要原因之一。
李又欣说:“LY03004上市后,”李又欣欣喜地表示。当绿叶的研发团队和国际注册团队准备好了临床前实验的资料,即理论上说,”
第三是了解和尊重FDA的规则。而免掉这么多试验过程的项目,还有定价和营销的优势,
(责任编辑:焦点)
 枞阳在线消息 团县委根据团市委《关于在全市村“两委”换届选举中抓好村级团组织集中换届工作的通知》(安青[2014]5号)文件要求,对全县村级团组织集中换届选举工作进行统一安排和部署。要求各乡镇团委要借
...[详细]
枞阳在线消息 团县委根据团市委《关于在全市村“两委”换届选举中抓好村级团组织集中换届工作的通知》(安青[2014]5号)文件要求,对全县村级团组织集中换届选举工作进行统一安排和部署。要求各乡镇团委要借
...[详细] 【#权威快报#|全面建成小康社会是#中国人权事业发展光辉篇章#】国务院新闻办公室12日发表《全面建成小康社会:中国人权事业发展的光辉篇章》白皮书。白皮书说,中国全面建成小康社会,夯实了人权基础,丰富了
...[详细]
【#权威快报#|全面建成小康社会是#中国人权事业发展光辉篇章#】国务院新闻办公室12日发表《全面建成小康社会:中国人权事业发展的光辉篇章》白皮书。白皮书说,中国全面建成小康社会,夯实了人权基础,丰富了
...[详细] 中新经纬客户端8月14日电 (熊家丽)今天是农历七月初七,即传统的七夕佳节,不少准新人希望能在这个寓意美好的日子办理结婚登记。虽然恰逢周六,又受疫情影响,但天津市、广东省汕头市、陕西省西安市、四川省成
...[详细]
中新经纬客户端8月14日电 (熊家丽)今天是农历七月初七,即传统的七夕佳节,不少准新人希望能在这个寓意美好的日子办理结婚登记。虽然恰逢周六,又受疫情影响,但天津市、广东省汕头市、陕西省西安市、四川省成
...[详细] 企业“家规”不可逾越法律红线企业奇葩规章制度屡见不鲜随意侵害劳动者合法权益□ 本报记者赵晨熙手机铃声必须使用统一音乐,否则就要被扣除绩效工资;员工上厕所有时间限制,短时间内连续上厕所要被罚款;员工因为
...[详细]
企业“家规”不可逾越法律红线企业奇葩规章制度屡见不鲜随意侵害劳动者合法权益□ 本报记者赵晨熙手机铃声必须使用统一音乐,否则就要被扣除绩效工资;员工上厕所有时间限制,短时间内连续上厕所要被罚款;员工因为
...[详细] 任命:方晓侯为枞阳县人民法院执行局局长;周正春为枞阳县人民法院民事审判第一庭庭长;钱立桃为枞阳县人民法院民事审判第三庭庭长;张勇为枞阳县人民法院刑事审判庭庭长;姚朴素为枞阳县人民法院执行局副局长;周会
...[详细]
任命:方晓侯为枞阳县人民法院执行局局长;周正春为枞阳县人民法院民事审判第一庭庭长;钱立桃为枞阳县人民法院民事审判第三庭庭长;张勇为枞阳县人民法院刑事审判庭庭长;姚朴素为枞阳县人民法院执行局副局长;周会
...[详细] ...[详细]
...[详细] 今天(11日)下午,北京市召开疫情防控第238场例行新闻发布会,通报疫情相关情况。北京市委教育工委副书记、市教委新闻发言人李奕介绍了京外中小学幼儿园师生员工返京返校要求。一、在京外低风险地区的中小学幼
...[详细]
今天(11日)下午,北京市召开疫情防控第238场例行新闻发布会,通报疫情相关情况。北京市委教育工委副书记、市教委新闻发言人李奕介绍了京外中小学幼儿园师生员工返京返校要求。一、在京外低风险地区的中小学幼
...[详细] 图:内地首个1152芯大芯数光缆项目落地横琴。/大公报记者方俊明摄【大公报讯】记者方俊明珠海报道:记者13日获悉,内地首个“1152芯大芯数光缆”项目落地珠海横琴。该项目具有光纤密度大、集成度高等优势
...[详细]
图:内地首个1152芯大芯数光缆项目落地横琴。/大公报记者方俊明摄【大公报讯】记者方俊明珠海报道:记者13日获悉,内地首个“1152芯大芯数光缆”项目落地珠海横琴。该项目具有光纤密度大、集成度高等优势
...[详细] 为深入贯彻落实新《安全生产法》,更好地执行落实国家安全生产法律法规,全面掌握新《安全生产法》有关条款,规范作业,减少生产安全事故的发生,实现安全生产。根据公司办公会要求,枞阳海螺公司于2014年9月2
...[详细]
为深入贯彻落实新《安全生产法》,更好地执行落实国家安全生产法律法规,全面掌握新《安全生产法》有关条款,规范作业,减少生产安全事故的发生,实现安全生产。根据公司办公会要求,枞阳海螺公司于2014年9月2
...[详细]